癌症的有关方面一直都备受关注,无论是在癌症本身的患病率还是癌症的治疗方面,研发一种能有效预防或能有效控制癌症的手段,都是大家所期望的。谢恬教授团队从浙八味中药温郁金中提取抗癌活性成分榄香烯,基于“分子配伍”理论,成功研发出我国自主知识产权的抗癌药——榄香烯脂质体(包括榄香烯乳状注射液、榄香烯口服乳)。榄香烯脂质体是全球首个仅含碳氢元素的抗癌新药,也是首个抗肿瘤中药脂质体纳米制剂,打破了药物化学教科书“无氮氧不成药”的观念。不过,浅表性肿瘤缺乏适宜的治疗技术,微针技术在局部通过皮内释放,具有治疗浅表性肿瘤的先天优势,随着微针技术的出现,药物联合感光材料组装在一起成为可能,团队将榄香烯和感光材料载于微针,制备了高效递送-高效抗癌的PDMS-ICG微针皮内给药系统。开辟了一种榄香烯类难溶性小分子高效透皮吸收的新方法,建立了一种高效、安全、使用方便、依从性好的浅表性肿瘤黑色素瘤的临床治疗新技术。同时我们研究发现实体瘤巨噬细胞突变可重编程免疫抑制肿瘤微环境(TME),设计制备Lipo@CpG - FA和AS1411 - Lipo@Ele - FA两种纳米制剂用于乳腺癌的治疗。前者能靶向M2 - TAMs并促其向M1转化,逆转抑制性TME,激活免疫、改变肿瘤类型并促进T细胞浸润;后者能杀4T1细胞、抑制M2 - TAM增殖。基于以上研究成果,我们撰写了两篇文章,同时发表于中科院一区Top期刊Journal of Pharmaceutical Analysis。
用于输送中药榄香烯的可渗透性聚二甲基硅氧烷微针
第一作者:田常庆
通讯作者:谢恬,王淑玲
期刊名称:Journal of Pharmaceutical Analysis
影响因子:6.1
通讯单位:杭州师范大学药学院
浙江省榄香烯类抗癌药物研究重点实验室,浙江省中药资源开发与应用工程研究中心,浙江省2011协同创新中心“浙八味”等浙产中药材综合利用开发协同创新中心
山东省粘膜与皮肤给药技术重点实验室
山东省药科学院 山东省新型缓控释制剂及靶向给药系统工程研究中心
福建中医大学第二附属医院神经内科
论文DOI:https://doi.org/10.1016/j.jpha.2024.101094
创新点:
设计了一种含有吲哚菁绿和榄香烯的两层微针。
将挥发性传统中药与透气性 PDMS 合用,促进透皮释放。
这项工作的 MNs 丰富了抗癌药物榄香精的新剂型。
研究背景:
黑色素瘤是源于皮肤或黏膜黑色素细胞的高恶性肿瘤,侵袭性强、易转移,患者表现为皮肤、黏膜出现不规则、颜色不均的斑块、结节,可能伴瘙痒、疼痛、出血。若不及时治疗,会扩散全身,危及生命。当前黑色素瘤治疗手段有手术、化疗、放疗、靶向和免疫治疗等。但因肿瘤侵袭性和转移性强、异质性高、治疗手段有局限、患者个体差异大等,根治困难。
微针(MNs) 作为透皮给药系统是利用微细针状器械对皮肤软组织实施机械性或物理性微创损伤刺激,以获得治疗作用的医疗技术。将其用于黑色素瘤治疗,借助微针在皮肤形成微孔,提高药物透皮吸收效率,增强治疗功效,突破了传统治疗中药物难以有效送达肿瘤部位、肿瘤细胞耐药等瓶颈,为黑色素瘤治疗带来新方向。
榄香烯(ELE)从温郁金中成功分离出来,并具有许多抗肿瘤和治疗作用。已使用 ELE 注射液和口服乳剂;然而,ELE 的不溶性和挥发性特性限制了其在 MN 中的使用。因此,为传统挥发性中药设计一种新型 MN 递送系统具有重要意义。
研究思路:
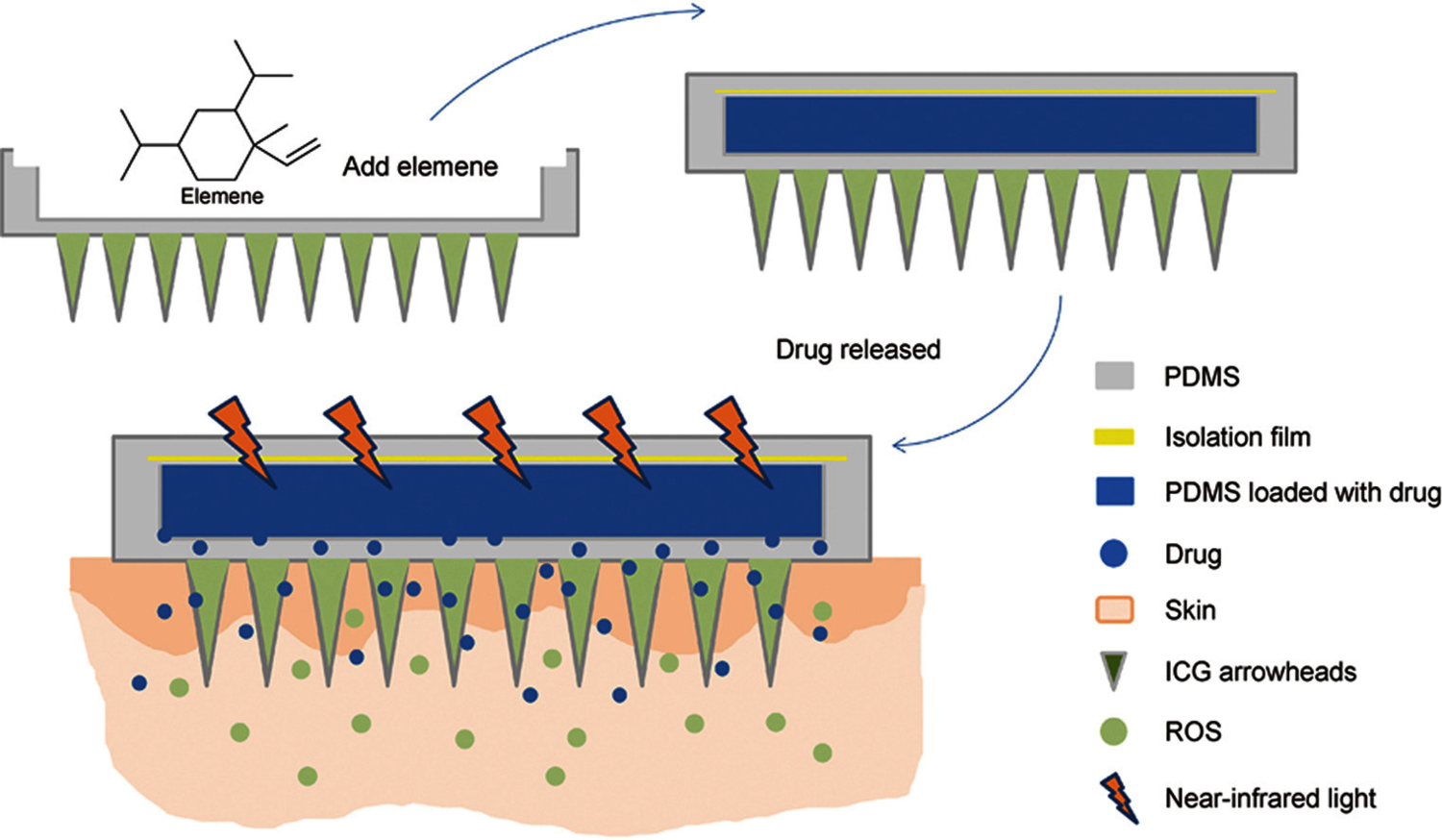
我们采用了聚二甲基硅氧烷 (PDMS)(Dow Corning, Midland, MI, USA),这是一种新型疏水性有机硅生物材料,具有高弹性和全透明性,在分子键合和交联中形成分子孔,并具有良好的透气性和透气性。当我们将 ELE 加载到 MNs 的基底时,它可以通过 PDMS 的毛孔扩散到皮肤中,发挥抗肿瘤作用。此外,光疗技术还具有良好的透明度。在此,我们发现了一种能够运输 ELE 的 MNs 基质材料 PDMS,并制备了 ELE 光敏 MN (ELE-MNs) 以实现药物联合给药并提高药物的治疗效果(图 S1)。
图1 PDMS负载微针透皮药物输送的示意图。
研究内容:
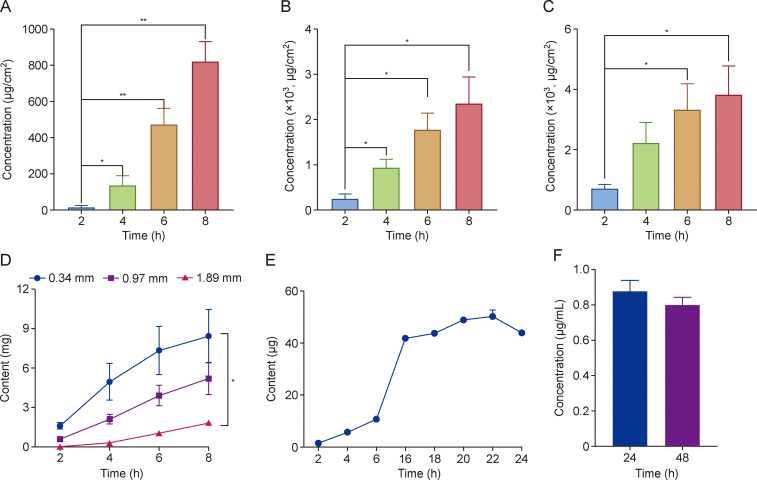
为验证榄香烯(ELE)穿透聚二甲基硅氧烷(PDMS)材料的能力,制备了三组厚度分别为0.34、0.97和1.89mm的PDMS用于扩散实验。利用高效液相色谱(HPLC)在2小时首个采样点,于三组中均检测到β-ELE,表明ELE可渗透PDMS晶圆。依据ELE标准曲线与筛选的接收液可知,6mL接收液中,随时间推移,PDMS晶圆渗透的ELE量逐渐增加。8小时内的ELE穿透性对比显示,ELE能有效穿透不同厚度的PDMS,且PDMS越薄,ELE穿透力越强。8小时时,0.34、0.97和1.89mm的PDMS渗透的ELE量分别达8.43、5.20和1.81mg,这为制备PDMS微针(MN)奠定基础。
图2 聚二甲基硅氧烷 (PDMS) 和榄香烯 (ELE) - 微针 (MNs) 中的药物在体内和体外释放。(A) 0.34 mm PDMS 片剂组在 8 小时内释放药物。∗P < 0.05 且∗∗P < 0.01。(B) 0.97 mm PDMS 片剂组在 8 小时内释放药物。∗P < 0.05。(C) 1.89 mm PDMS 片剂组在 8 小时内释放药物。∗P < 0.01。(D) 三组不同厚度的 PDMS 在 8 小时内的总药物渗透率。∗P < 0.05。(E) ELE-MNs 的体外经皮药物释放。(F) 在 24 小时和 48 小时时检测小鼠血浆中的药物含量。数据以平均值±标准差 (SD) 表示 (n = 3)。
通过两步铸造工艺制造出两层MN系统,每个阵列含100(10×10)个锥形针,针尖长1000nm,间距1000nm。选用PDMS单体A和B作MN基体材料,测试10:1和5:1的重量比,选定10:1。为防ELE挥发,设计载药槽将其嵌入PDMS MN背衬层。制备不同重量比的PDMS混合物与ELE(5:1、10:1和20:1)以增加载药量,发现10:1载药的ELE-MNs释药量更高,且MN体完整、包衣效果好,所以确定10:1为包埋条件。
PDMS MN透光率良好,42°C时ELE渗透性更佳。将其与吲哚菁绿(ICG)结合,以ICG:PDMS = 1:50质量比嵌入MN尖端(ICG-ELE-MNs)。近红外光下,ICG-ELE-MNs中的ICG将光能转化为热能并释放活性氧,促进药物释放与肿瘤治疗。
通过立体显微镜观察MN尖端受力形态变化研究其穿刺能力,MN尖端加载10g(0.098N)至500g(4.9N)后虽弯曲但不断裂,在猪皮表面留下清晰完整阵列,表明MN坚固不易断裂。
ELE透皮递送研究显示,2小时药物量最少,随后逐渐增加,16小时后增速趋缓,22小时开始减少,最大释药量49.01μg,表明ELE-MNs贴剂能成功将ELE递送至皮肤。
选择健康裸鼠腹部注射ELE-MNs研究其体内药物递送能力,血样中检测到ELE,24和48小时药物浓度达0.8μg/mL ,说明ELE-MNs可穿透裸鼠皮肤进入真皮及血液循环。
将B16细胞皮下注射到雌性C57BL/6小鼠体内建立黑色素瘤模型,经杭州师范大学动物伦理与福利委员会批准并按相关指南开展动物研究,以探究ELE-MNs和ICG-ELE-MNs经皮递送ELE的抗肿瘤作用。结果显示,ELE-MN、ICG-MN和ICG-ELE-MN组的肿瘤体积和重量显著低于其他组,荷瘤小鼠体重无显著变化,表明ELE-MN和ICG-ELE-MN成功将ELE递送至肿瘤部位发挥抗癌作用,且MN透皮系统递送ELE的治疗方法安全有效。
研究总结:
综上所述,由 ICG 尖端和 ELE 基底组成的两层 ELE-ICG-MNs 通过联合化疗成功制备用于黑色素瘤治疗。这些结果证明了 ELE-MNs 和 ELE-ICG-MNs 的抗肿瘤作用,并证实制备的 MNs 抑制肿瘤生长,可能成为黑色素瘤治疗有效 ELE 递送的潜在系统。
使用协同纳米制剂对肿瘤相关巨噬细胞进行原位复极化以逆转小鼠乳腺癌中免疫抑制 TME 用于癌症治疗
第一作者:罗汝婳
通讯作者:谢恬,王淑玲,田庆常
期刊名称:Journal of Pharmaceutical Analysis
影响因子:6.1
通讯单位:杭州师范大学药学院
浙江省榄香烯类抗癌药物研究重点实验室,浙江省中药资源开发与应用工程研究中心,浙江省2011协同创新中心“浙八味”等浙产中药材综合利用开发协同创新中心
武汉市汉口医院药学部
论文DOI:https://doi.org/10.1016/j.jpha.2024.01.009
创新点:
M2 表型巨噬细胞靶向 Lipo@CpG-FA 用于 TAMs 复极化和逆转免疫抑制 TME。
协同纳米制剂减少了 M2 巨噬细胞并导致 4T1 乳腺癌的消退和抑制。
Elemene 可通过增强治疗效果来抑制 M2 巨噬细胞增殖的效果。
研究背景:
乳腺癌是发生在乳腺上皮组织的恶性肿瘤,是女性最常见的癌症之一,极少数男性也可能患病。其发病与遗传、激素水平、生活方式等多种因素相关。早期症状可能不明显,随着病情发展,乳房会出现肿块、乳头溢液、皮肤橘皮样改变等症状。
癌症免疫疗法是一种新型的癌症治疗策略。越来越多的研究表明,免疫抑制性肿瘤微环境 (TME) 可以抑制效应 T 细胞攻击肿瘤细胞,这是实体瘤免疫治疗中的关键问题。
巨噬细胞丰富,对肿瘤的免疫微环境有影响。TME 中的大多数白细胞是 M2 表型巨噬细胞,可促进肿瘤生长并引起免疫抑制。M1 表型巨噬细胞不仅杀死肿瘤细胞,而且还在协调癌症相关炎症 (CRI) 中发挥主导作用。肿瘤相关巨噬细胞 (TAM) 从 M2 表型转化为 M1 表型似乎是逆转免疫抑制性 TME 的主要途径。
研究思路:
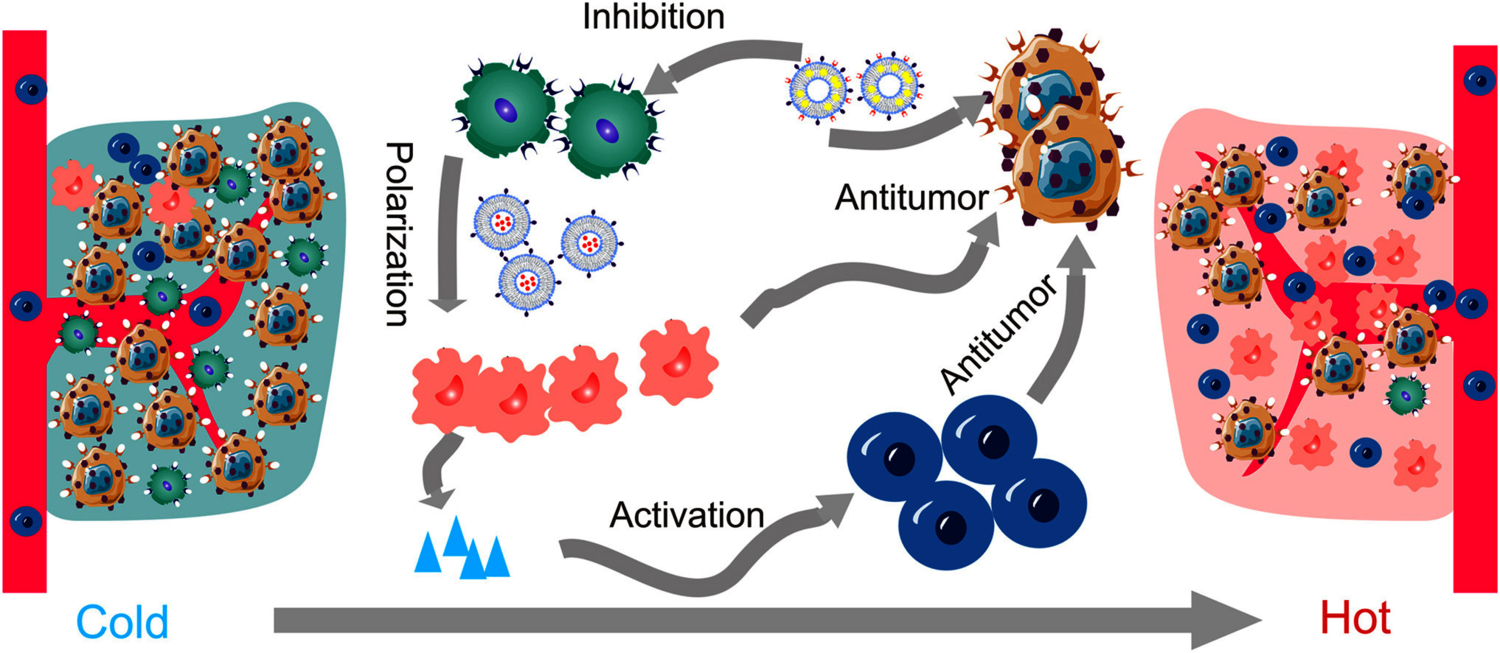
本研究描述了一种通过使用 CpG 脂质体和榄香烯 (Ele) 脂质体将 M2-TAMs 复极为杀瘤 M1 表型,将“冷”肿瘤转化为“热”肿瘤的联合治疗策略(图 3)。CpG 寡脱氧核苷酸 (ODN) 可以刺激一连串的先天免疫反应。Lipo@CpG-叶酸 (FA) 是一种 M2 表型巨噬细胞靶向 CpG ODNs 递送系统,用于对肿瘤相关巨噬细胞进行复极化。Ele 是一种源自姜黄的有效倍半萜烯,除了低毒性和低副作用外,还具有多种抗肿瘤和疗效 。Lipo@CpG-FA 与 FA-Lipo@Ele-AS1411 的组合抑制了 4T1 乳腺癌,并逆转了 TME 中 M2-TAMs 介导的免疫抑制。
图3 CpG脂质体和榄香烯脂质体通过重新极化M2型肿瘤相关巨噬细胞至杀瘤性M1表型来逆转肿瘤微环境中的免疫抑制
研究内容:
在这项工作中,使用超声波分散法制备脂质体,其中 FA-1,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-聚乙二醇 (DSPE-PEG) 和 Chol-AS1411 通过孵育与脂质体连接(方法和其他一些结果显示在补充数据中)。结果,我们产生了两种类型的靶向脂质体:Lipo@CpG-FA 和 FA-Lipo@Ele-AS1411。使用激光扫描共聚焦显微镜 (LSCM) 完成细胞摄取研究。研究结果证实了 FA 和 AS1411 通过主动靶向增加摄取的作用,显着影响靶向脂质体的细胞摄取。
在未经处理的 Raw 264.7 细胞和 M2 表型巨噬细胞上研究了 Lipo@CpG-FA 的免疫刺激特性。与 Lipo@CpG-FA 共培养的白细胞介素-4 (IL-4) 诱导的 M2 表型巨噬细胞表现出 M1 表型转换的趋势,并且具有高度的促炎免疫反应,M1 巨噬细胞标志物上调。
然后测试一组 toll 样受体 (TLR) 通路激动剂刺激具有抗肿瘤功能(如吞噬作用)的巨噬细胞的能力。与 IL-4 组相比,Lipo@CpG-FA 可以逆转 M2 巨噬细胞对 M1 和巨噬细胞吞噬肿瘤细胞的能力。
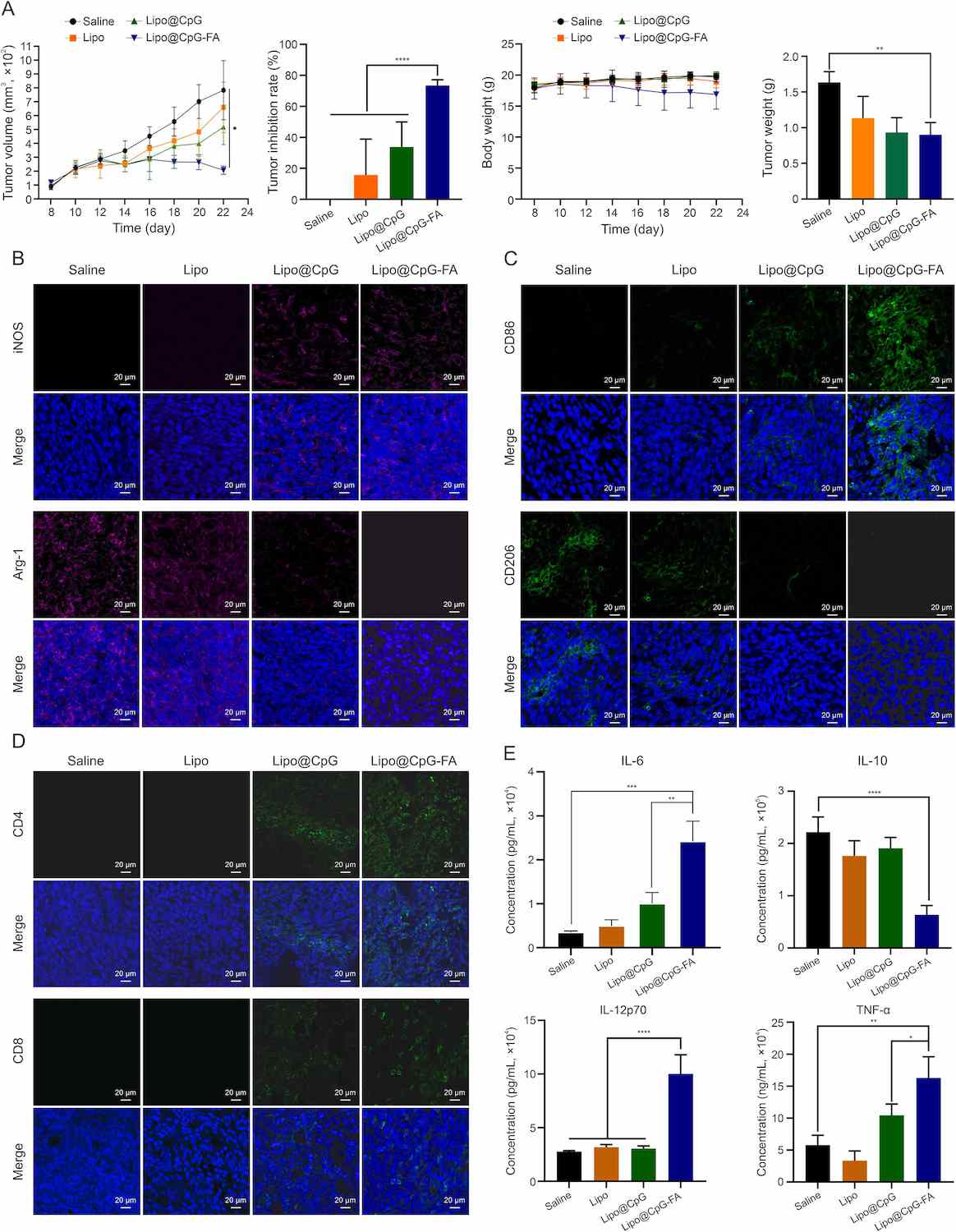
Lipo@CpG-FA 的抗肿瘤作用在 4T1 荷瘤小鼠模型中得到证实。该研究遵循了杭州师范大学动物伦理与福利委员会 (AEWC) 制定的所有指导方针(批准号:2021-1260)。Lipo@CpG-FA 是一种有效的抗肿瘤治疗,对小鼠体重无显著影响,无显著毒性作用。将 CpG 封装到 Lipo 和 Lipo-FA 中可显著提高抗肿瘤疗效,肿瘤抑制率分别提高到 33.77% ± 3.784% 和 73.45% ± 3.784%。
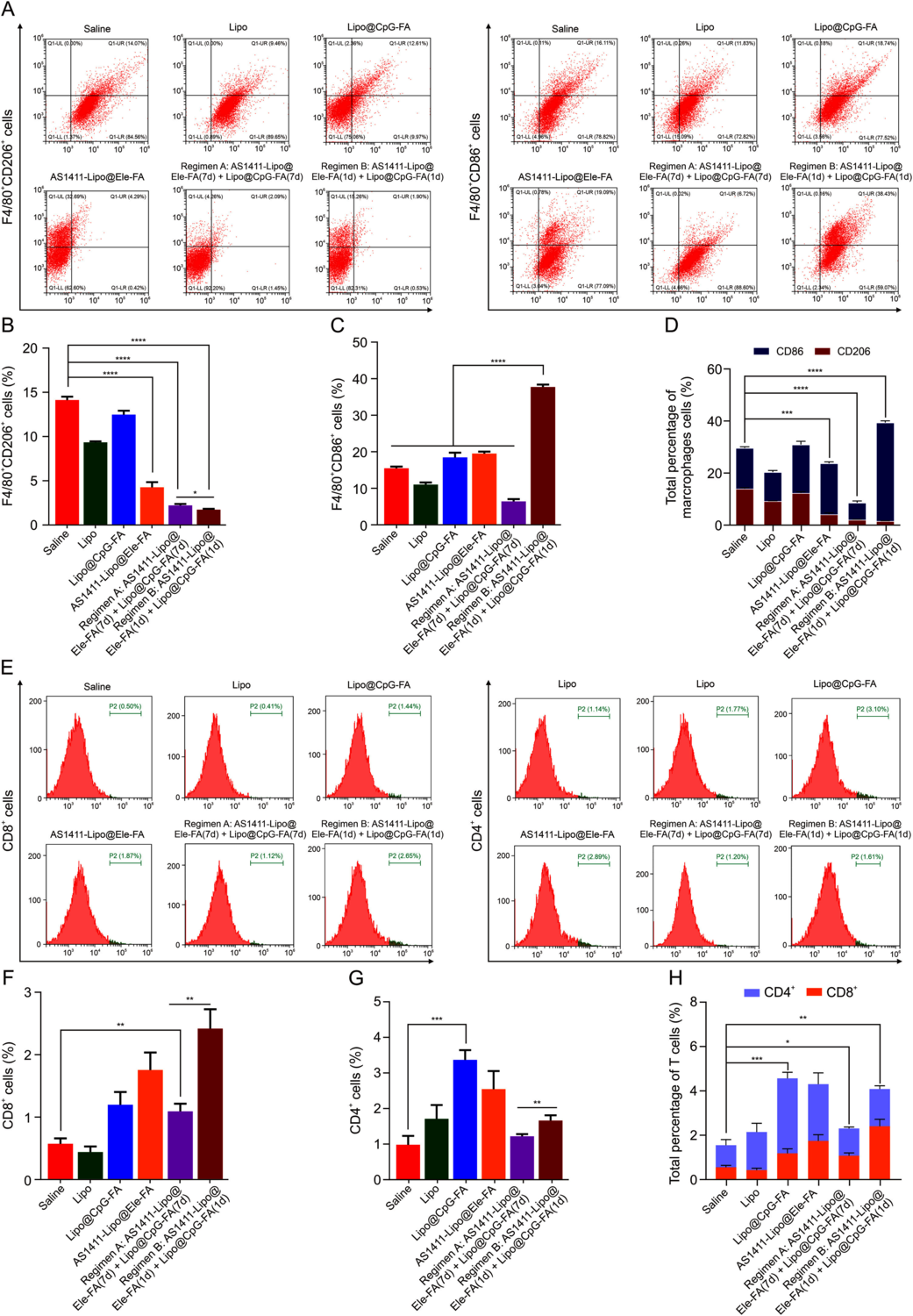
图4 .Lipo@CpG-叶酸 (FA) 通过消除 M2-TAM 重编程免疫抑制性肿瘤微环境 (TME)。(A) Lipo@CpG-FA 的体内抗肿瘤疗效。每隔一天瘤内注射生理盐水、Lipo (空白脂质体)、Lipo@CpG 和 Lipo@CpG-FA 的 4T1 荷受体小鼠的肿瘤生长曲线 (CpG 剂量,每只小鼠 4 μg)。不同制剂治疗的乳腺肿瘤的肿瘤抑制率曲线。不同组携带 4T1 的小鼠体重。实验结束时切除肿瘤的重量。数据表示均值±标准差 (SD) (n = 4)。∗∗P < 0.01,∗∗∗∗P < 0.0001。(二、三)共聚焦图像显示了肿瘤生长抑制研究中不同小鼠组 4T1 肿瘤组织的 M1 和 M2 巨噬细胞染色 (n = 3)。(D) 显示 4T1 肿瘤组织的 CD8 T 细胞和 CD4 T 细胞染色的共聚焦图像。(E) 接受指定治疗的小鼠 4T1 肿瘤组织中白细胞介素 (IL)-6、IL-10、IL-12p70 和肿瘤坏死因子-α (TNF-α) 分泌的酶联免疫吸附测定 (ELISA) 结果。++∗P < 0.05,∗∗P < 0.01,∗∗∗P < 0.001,∗∗∗∗P < 0.0001。数据表示 SD ±平均值 (n = 3)。iNOS: 诱导型一氧化氮合酶;Arg-1:精氨酸酶-1。
图 4.Lipo@CpG-叶酸 (FA) 与 AS1411-Lipo@elemene (Ele)-FA 一起通过消除 M2 肿瘤相关巨噬细胞 (TAM) 在肿瘤微环境 (TME) 中重编程免疫抑制。(A) 适应症治疗后 4T1 肿瘤中 M2-TAMs(F4/80 CD206 细胞)和 M1-TAMs(F4/80 CD86 细胞)的代表性流式细胞术谱。(二、三)M2-TAMs(F4/80 CD206 细胞)(B) 和 M1-TAMs(F4/80 CD86 细胞)(C)的代表性流式细胞术谱图谱。++++++++∗P < 0.05,∗∗∗∗P < 0.0001。(D) 适应治疗后 4T1 肿瘤中总 TAM 的代表性流式细胞术谱。∗∗∗P < 0.001,∗∗∗∗P < 0.0001。(E-G)指定治疗后 4T1 肿瘤中 CD4 T 和 CD8 T 细胞的代表性流式细胞术谱。++∗∗P < 0.01,∗∗∗P < 0.001。(H) 指定治疗后 4T1 肿瘤中总 CD4 T 和 CD8 T 细胞的代表性流式细胞术谱。++∗P < 0.05,∗∗P < 0.01,∗∗∗P < 0.001。数据表示平均值±标准差 (SD) (n = 3)。
研究总结:
实体瘤中巨噬细胞的突变可以重编程免疫抑制 TME。我们设计并制备了两种类型的纳米制剂:Lipo@CpG-FA 和 AS1411-Lipo@Ele-FA。Lipo@CpG-FA 证明了其有效靶向 M2-TAMs 并将 M2 巨噬细胞转化为 M1 表型的能力,从而在体外逆转抑制性 TME。它不仅激活了抗肿瘤免疫能力,还将“冷”肿瘤转化为“热”肿瘤,导致 CD4 和 CD8 T 细胞浸润。此外,AS1411-Lipo@Ele-FA 能够特异性杀死 4T1 细胞,同时还能抑制 TME 中的 M2-TAM 增殖。我们推断 Ele 可以抑制 M2 巨噬细胞或将 M2 转化为其他未知的巨噬细胞,但是,这些机制值得进一步研究。